TESTS FÜR BAKTERIELLES ENDOTOXIN: 10 Gründe, um den rekombinanten Faktor C zu wählen
Methoden mit dem rekombinanten Faktor C (rFC) des Pfeilschwanzkrebses sind die neueste und modernste Lösung für effektive bakterielle Endotoxin-Tests (BET). Dieses Whitepaper überprüft die Vorteile des rekombinanten Faktors C des Pfeilschwanzkrebses gegenüber den BET-Methoden, die derzeit weitverbreitet eingesetzt werden. Wir vergleichen die Leistung der LAL-Reagenzien mit rFC und fassen die Nachweise zusammen, die unsere 10 Gründe unterstützen, rFC zu wählen.
HINTERGRUND
Makrophagen, eine Art von Immunzellen, nutzen die Lipopolysaccharid (LPS)-Moleküle, aus denen die äußere Zellwand gramnegativer Bakterien besteht, um ihre Präsenz in Körpern nachzuweisen. LPS, auch bekannt als bakterielle Endotoxine, können eine schwere Reaktion im Immunsystem hervorrufen, die zu Fieber, Hypotonie, Übelkeit, Schock und Sepsis führt.
Schwere Reaktionen auf bakterielle Endotoxine können tödlich sein. Daher muss mit großer Sorgfalt darauf geachtet werden, dass sie nicht in Medizinprodukte gelangen, die mit dem Blutkreislauf oder der Hirnflüssigkeit eines Patienten in Kontakt kommen1,2. Leider ist die Vermeidung von Endotoxin-Kontaminationen bei pharmazeutischen Herstellungsprozessen keine einfache Aufgabe, da LPS-Moleküle in praktisch jeder Umgebung vorkommen. Daher gibt es strenge Vorschriften für die zulässigen Werte von Endotoxin-Kontaminationen in Medizinprodukten, injizierbaren Arzneimitteln und anderen medizinischen Lösungen, die mit dem Blut oder der Hirnflüssigkeit eines Patienten in Kontakt kommen können. Diese Produkte müssen daher vor der Freigabe auf Endotoxin-Kontamination getestet werden3.
EIN HISTORISCHER ABRISS DER ENDOTOXIN-TESTS MIT LAL
In den 1960er Jahren entdeckten Wissenschaftler, dass das isolierte Lysat des atlantischen Pfeilschwanzkrebses (Limulus-Amöbozyten-Lysat -LAL) bei der Präsenz von bakteriellen Endotoxinen koagulierte. Rund 10 Jahre später stellten Forscher außerdem fest, das der gleiche Prozess im vom asiatischen Pfeilschwanzkrebs isolierten Lysat (Tachypleus- Amöbozyten-Lysat - TAL) ablief. Von ihrer Entdeckung beflügelt, entwickelten sie Tests zum Nachweis bakterieller Endotoxine mit LAL- und TAL-Reagenzien, die 1983 vom US-amerikanischen Arzneibuch übernommen wurden2,4.
Drei anerkannte Haupttestmethoden verwenden LAL- und TAL-Reagenzien für Endotoxin-Tests: Gel-Clot-Tests (beschränkt und halbquantitativ), turbidimetrische und chromogene Assays (Endpunkt- und kinetische Methoden). Die LAL-/TAL-Tests funktionieren alle gleich: Die Präsenz von bakteriellen Endotoxinen in einer Probe setzt eine Kaskade von Reaktionen in Gang, die zu einer Veränderung der Trübung oder Farbe führen (siehe Abbildung 1)4,5.
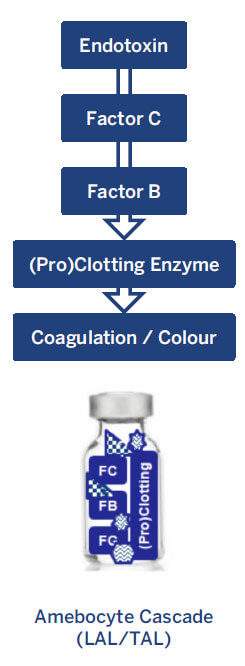 Das Amöbozyten-Lysat enthält eine Mischung aus natürlich vorkommenden Proteinen, die am Endotoxin-Nachweisprozess beteiligt sind. Faktor C fungiert als Hauptbiosensor, indem er sich mit bakteriellen Endotoxinen verbindet und ein anderes Protein namens Faktor B aktiviert. Faktor B wandelt dann ein Progerinnungsenzym in ein Gerinnungsenzym um.
Das Amöbozyten-Lysat enthält eine Mischung aus natürlich vorkommenden Proteinen, die am Endotoxin-Nachweisprozess beteiligt sind. Faktor C fungiert als Hauptbiosensor, indem er sich mit bakteriellen Endotoxinen verbindet und ein anderes Protein namens Faktor B aktiviert. Faktor B wandelt dann ein Progerinnungsenzym in ein Gerinnungsenzym um.
Das sich ergebende Gerinnungsenzym katalysiert eine Reaktion, die eine Änderung der Viskosität, Trübung oder Farbe herbeiführt, die erfasst wird, um die Konzentration der Endotoxine in der Probe zu bestimmen4,5.
LAL: UMWELTAUSWIRKUNGEN UND -EINSCHRÄNKUNGEN
Obwohl LAL und TAL in der Pharmabranche weitverbreitet sind (vor allem weil sie einen empfindlichen Nachweis von Endotoxinen bieten), haben sie mehrere Nachteile. LAL- und TAL-Tests sind anfällig für falsch-positive Ergebnisse. Darüber hinaus reduziert die relativ hohe Abweichung von Charge zu Charge bei natürlichen Lysat-Reagenzien deren Zuverlässigkeit und Vergleichbarkeit4,6.
Das vielleicht größte Problem mit LAL- und TAL-Reagenzien ist, dass sie von
Pfeilschwanzkrebsen gewonnen werden müssen. Die Population des atlantischen Pfeilschwanzkrebses wurde in den vergangenen 15 Jahren um 90 % dezimiert. Die Spezies wird nun von der IUCN als anfällig beschrieben und steht auf deren roten Liste der gefährdeten Arten. Die Population des asiatischen Pfeilschwanzkrebses ist ähnlich betroffen und gilt jetzt als gefährdet6,7.
Da der Verkauf und die Herstellung von Arzneimitteln weiter zunehmen, steigt auch die Nachfrage nach Endotoxin-Testreagenzien. Aufgrund der Dezimierung des Pfeilschwanzkrebses ist die Verwendung von LAL und TAL zum Testen von bakteriellen Endotoxinen nicht mehr tragbar. Außerdem werden LAL und TAL nur in bestimmten Regionen produziert, daher ist ihre Verfügbarkeit in manchen Regionen der Welt beschränkt6.
Damit die Sicherheit von Arzneimitteln weiterhin gewährleistet werden kann, liegt es auf der Hand, dass wir einen alternativen Endotoxin-Test benötigen, der nicht nur nachhaltig, sondern auch weithin verfügbar ist und der stetig wachsenden Nachfrage nach Endotoxin-Tests gerecht wird.