TESTE DE ENDOTOXINAS: 10 motivos para escolher o Fator C recombinante
Os métodos do Fator C Recombinante (rFC) dos límulos são a solução mais recente para o teste eficaz de endotoxinas bacterianas (BET). Este relatório analisa as vantagens do Fator C Recombinante (rFC) do límulo em relação aos métodos BET utilizados atualmente em grande escala. Comparamos o desempenho dos reagentes LAL com o rFC, e resumimos as evidências que sustentam nossos 10 motivos para escolher o rFC.
HISTÓRIA
Os macrófagos, um tipo de célula do sistema imune, utilizam as moléculas de lipopolissacarídeo (LPS) que compõem a parede celular externa das bactérias Gram-negativas para detectar a sua presença no corpo. Os LPS, também conhecidos como endotoxinas bacterianas, podem causar uma forte resposta imune, manifestada por febre, baixa pressão arterial, náuseas, choque e sepse.
As endotoxinas bacterianas podem causar reações graves e potencialmente fatais e, portanto, deve-se ter muito cuidado para evitar que cheguem a dispositivos médicos que entrem em contato com a corrente sanguínea ou líquido cefalorraquidiano de um paciente1,2. Infelizmente, evitar a contaminação por endotoxinas nos processos de produção de produtos farmacêuticos não é uma tarefa fácil, pois as moléculas de LPS estão presentes em praticamente todos os ambientes. Consequentemente, os níveis aceitáveis de contaminação por endotoxinas são estritamente regulamentados para categorias como dispositivos médicos, produtos farmacêuticos injetáveis e outras soluções médicas que podem entrar em contato com o sangue ou líquido cerebral de um paciente. Por isso, estes produtos devem, ser testados para garantir que estejam isentos de contaminação por endotoxinas antes de poderem ser liberados3.
UMA BREVE HISTÓRIA DOS TESTES DE ENDOTOXINAS COM LAL
Na década de 1960, cientistas descobriram que o lisado isolado dos límulos do Atlântico (Lisado de Amebócito de Limulus -LAL) coagulou-se na presença de endotoxinas bacterianas. Cerca de 10 anos depois, os pesquisadores descobriram, também que, o mesmo processo ocorreu no lisado isolado do límulo asiático (Lisado de Amebócito de Tachypleus - TAL). Animados pela sua descoberta, desenvolveram testes ara detectar endotoxinas bacterianas utilizando reagentes LAL e TAL, e estes ensaios foram posteriormente adotados pela Farmacopeia dos EUA em 19832,4.
Três principais metodologias de ensaio aprovadas utilizam reagentes LAL e TAL para testes de endotoxinas: ensaios Gel Clot (restritos e semiquantitativos), Turbidimétricos e Cromogênicos (métodos de endpoint e cinéticos). Os testes LAL/TAL funcionam de forma semelhante: a presença de endotoxinas bacterianas numa amostra desencadeia uma cascata de reações, resultando numa mudança de turbidez ou cor (ver Figura 1)4,5.
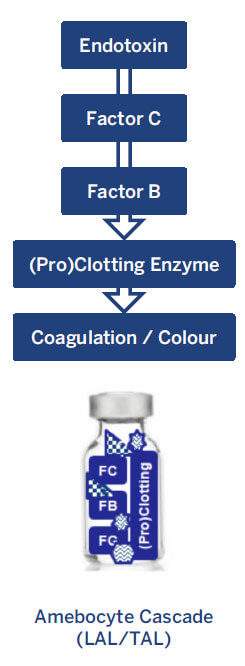 O lisado de amebócito contém uma mistura de proteínas de origem natural envolvidas na detecção de endotoxinas. O Fator C atua,então, como o biossensor principal ligando-se a endotoxinas e ativando outra proteína chamada Fator B. O fator B converte então uma enzima pré-coagulante numa enzima de coagulação.
O lisado de amebócito contém uma mistura de proteínas de origem natural envolvidas na detecção de endotoxinas. O Fator C atua,então, como o biossensor principal ligando-se a endotoxinas e ativando outra proteína chamada Fator B. O fator B converte então uma enzima pré-coagulante numa enzima de coagulação.
A enzima de coagulação resultante catalisa, então, uma reação que provoca uma alteração na viscosidade, turbidez ou
cor, que é dectetada visando determinar a concentração de endotoxinas na amostra4,5.
LAL: LIMITAÇÕES E IMPACTOS AMBIENTAIS
Embora o LAL e o TAL sejam amplamente utilizados na indústria farmacêutica (principalmente porque oferecem uma detecção sensível de endotoxinas), têm várias desvantagens. Os testes LAL e TAL são suscetíveis a resultados falso-positivos. Além disso, a variação relativamente elevada entre lotes de reagentes lisados naturais reduz a sua confiabilidade e comparabilidade4,6.
Talvez o maior problema com os reagentes LAL e TAL é que eles têm de ser extraídos dos
límulos. A população destes animais, no Atlântico, foi dizimada em 90% nos últimos 15 anos e a espécie está agora listada como vulnerável na Lista Vermelha de Espécies Ameaçadas da União Internacional para a Conservação da Natureza (IUCN). A população asiática sofreu um destino semelhante e está agora listada como ameaçada de extinção6,7.
À medida em que as vendas e a produção de produtos farmacêuticos continuam a crescer, aumenta também a procura de reagentes para testes de endotoxinas. Devido à dizimação dos límulos, a utilização de LAL e TAL para testar endotoxinas bacterianas já não é sustentável. Além disso, o LAL e o TAL são produzidos apenas em certas regiões e a sua disponibilidade é, portanto, limitada em algumas partes do mundo6.
Para garantir a segurança contínua dos nossos produtos farmacêuticos, é evidente que precisamos de um teste de endotoxinas alternativo que seja não apenas sustentável, mas também amplamente disponível e que satisfaça a crescente demanda da indústria farmacêutica.